Konfokale Mikroskopietechniken
Konfokale Raman- und Lumineszenzmikroskopie bei Zimmertemperatur
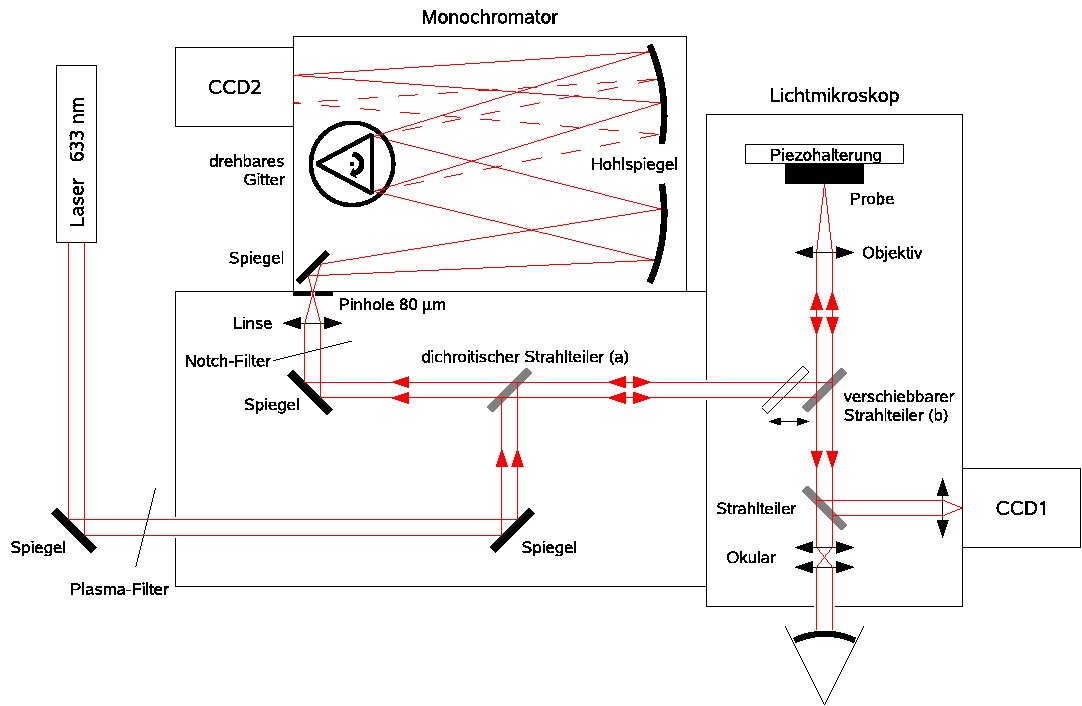
Optischer Aufbau unseres konfokalen Raman-Mikroskopes.
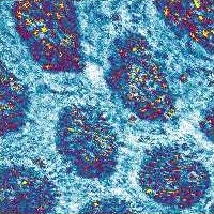
Ausschnitt aus dem Facettenauge einer Hummel. Bildgröße 55 × 55 µm.
In einem konfokalen Mikroskop wird — im Gegensatz zu herkömmlichen Mikroskopen — nicht ein ganzer Probenausschnitt gleichzeitig beleuchtet und beobachtet, sondern das Signal geht jeweils nur von einem beugungsbegrenzten Fleck aus, auf den ein paralleles Laserlichtbündel mit einem Objektiv hoher numerischer Apertur fokussiert wird. Das von diesem Fokus ausgehende Streulicht wird von dem selben Objektiv gesammelt und kollimiert und mit einer weiteren Linse durch eine winzige Lochblende ("Pinhole") fokussiert, hinter der sich ein Photodetektor befindet. Nur Streulicht, das von der Fokusebene des Probenobjektives ausgeht, gelangt durch die Blende; aus anderen Tiefen der Probe stammendes Licht ist in der Blendenebene defokussiert und wird wirksam abgeblockt.

Oberflächenstrukturen eines älteren EPROM-Chips, aufgenommen im elastisch gestreuten Laserlicht (links) und im Signal der intensiven Raman-Linie von Silizium bei 520 cm-1 (rechts). Bildgröße 100 × 100 µm.
Die Lochblende bewirkt dadurch eine Tiefenselektion: Probenbereiche außerhalb der Fokusebene liefern keine unscharfen Beiträge zum Bild, sondern sind dunkel. Das bietet die Möglichkeit, die Probe in Form von Tiefenschnitten dreidimensional abzubilden. Der Preis für diese Vorteile besteht darin, dass die Probe relativ zum Laserfokus abgerastert werden muss. Hierzu wird entweder die Probe oder ein optisches Element im Strahlengang (z. B. ein Spiegel) mit einem Piezotranslator bewegt.
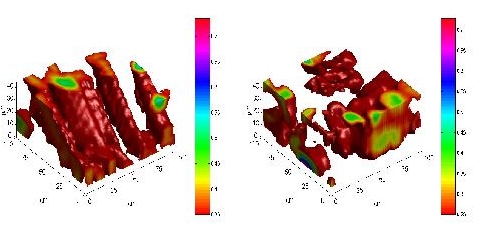
Dreidimensionale Anordnung der Körnchen von künstlichem Karlsbader Salz, aufgenommen mit konfokaler Raman-Mikroskopie. Verteilung der Ionen SO42- (ν = 985 cm-1, links) und HCO3- (ν = 1033 cm-1, rechts).
Ein konfokales Mikroskop kann leicht dadurch erweitert werden, dass man nicht das gewöhnliche Streulicht detektiert, sondern andere Arten von Sekundärstrahlung, die vom Laserfokus ausgehen. Diese können z. B. Fluoreszenz, Photolumineszenz, Raman-Streulicht oder — im Fall optisch nichtlinearer Materialien — die zweite oder dritte Harmonische des Anregungslichtes umfassen.
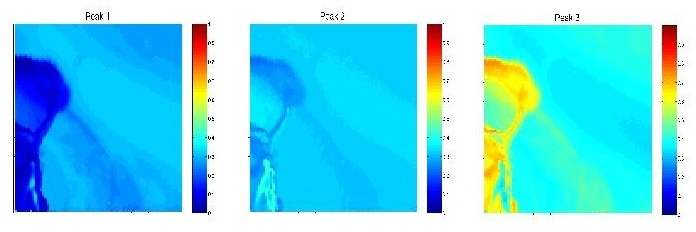
Räumliche Verteilung dreier Kristallmodifikationen an der Oberfläche eines GaSe-Einkristalles. Die Modifikationen wurden an Hand der Emissionswellenlänge ihrer Wannier-Exzitonen in der direkten Bandlücke identifiziert. Bildgröße 100 × 100 µm.
Dadurch wird die Apparatur zum konfokalen Fluoreszenz- oder Raman-Mikroskop. Die unterschiedlichen spektralen Komponenten des kollimierten Sekundärlichtes werden meist in einem Monochromator getrennt, dessen Eintrittsspalt durch die kleine Lochblende ersetzt wird. Zur Verkürzung der Messzeit wird eine gekühlte CCD-Linienkamera in der Austrittsspaltebene positioniert, so dass das gesamte Spektrum parallel aufgenommen werden kann.
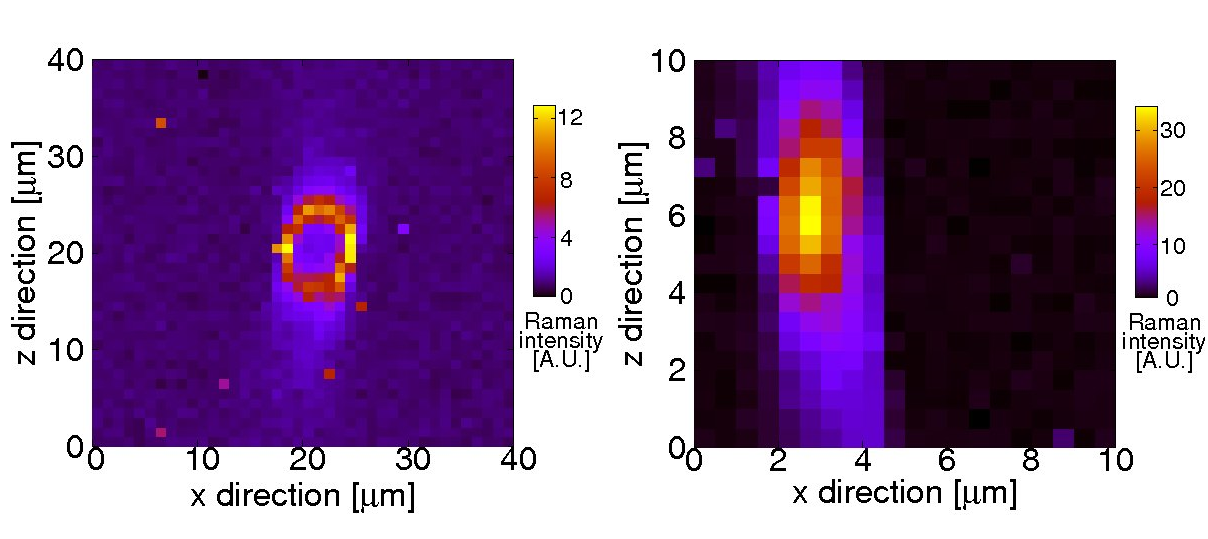
Querschnitt durch die Spinnenfäden zweier verschiedener Spinnenarten. Das obere Bild zeigt einen Faden, der innen hohl ist; ein kompakter ist auf der unteren Seite zu sehen. Dargestellt ist die farbkodierte Intensitätsverteilung charakteristischer Raman-Linien der Spinnenfäden.
Indem man die integrierte Intensität einer oder mehrerer charakteristischer Raman- oder Lumineszenzlinien als Funktion der Position des Laserfokus auf der Probe aufzeichnet, kann man ein Abbild ihrer chemischen Zusammensetzung zerstörungsfrei auf rein optischem Wege erhalten.
Konfokale Fluoreszenzlebensdauer-Mikroskopie (FLIM)
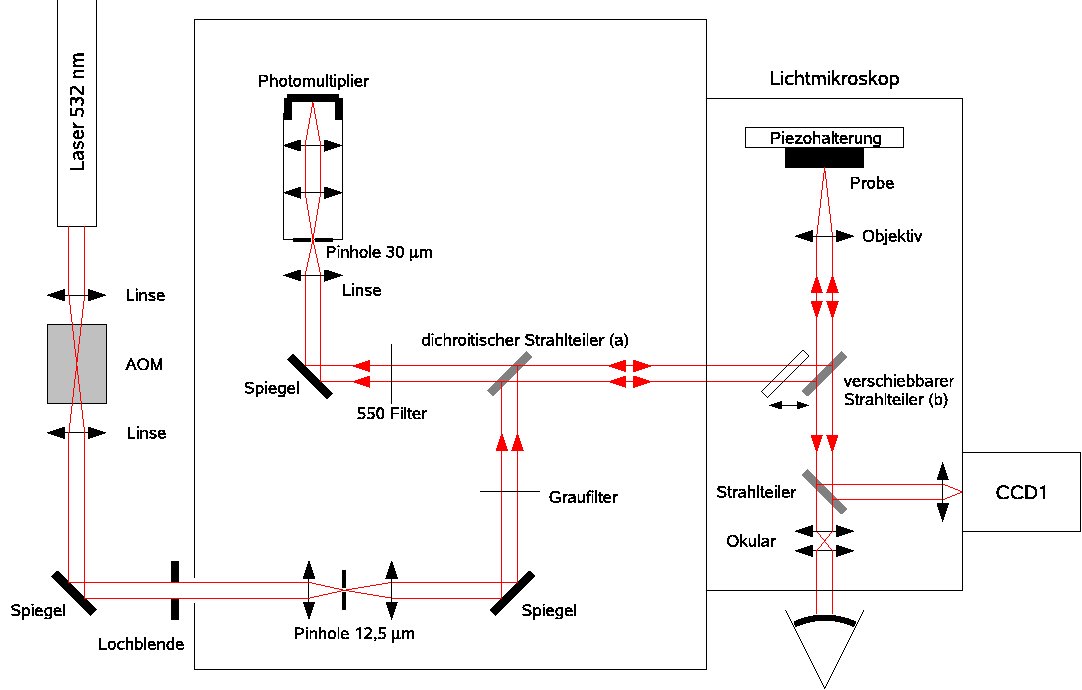
Optischer Aufbau der FLIM-Apparatur.
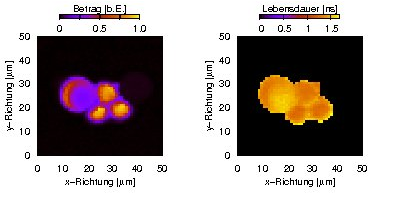
Fluoreszenzintensität (links) und -lebensdauer (rechts) fluoreszierender Polymerkügelchen.
Die gewöhnliche Fluoreszenzmikroskopie kann zur ortsaufgelösten Messung der Fluoreszenzlebensdauern (fluorescence lifetime imaging microscopy; FLIM) erweitert werden. Unsere Apparatur arbeitet in der Frequenzdomäne. Hierbei wird der zur Anregung verwendete Dauerstrichlaser mit einem akustooptischen Modulator (AOM) im Frequenzbereich einiger 10 MHz amplitudenmoduliert, und das ebenfalls modulierte Fluoreszenzsignal wird phasenempfindlich detektiert. Auf Grund der endlichen Fluoreszenzlebensdauer ist dieses gegenüber der Anregung phasenverschoben, und seine Modulationsamplitude ist verringert. Aus beiden Effekten kann die Fluoreszenzlebensdauer berechnet werden.
